Ключевые слова: рак молочной железы и яичников, первично–множественный рак, метилирование, гены RASSF1A, RARβ2 и SEMA3B.
За последнее десятилетие изучение феномена первичной множественности опухолей приобретает все большую актуальность и значимость в онкологии. Это связано в первую очередь с повсеместным увеличением числа больных данной патологией [6,7]. В России показатель заболеваемости первично–множественными злокачественными опухолями (ПМЗО) в 2005 г. составил 8,3, а в 2010 г. – 11,2 на 100 тыс. населения. При этом доля синхронных опухолей достигла 33% [5].
Под первичной множественностью опухолей в настоящее время понимают независимое возникновение и развитие у одного больного двух или более новообpазований. При этом пораженными могут быть не только разные органы различных систем, но и парные (молочные железы, легкие и др.), а также мульцентрически один орган.
Особое внимание уделяют изучению первично–множественных злокачественных новообразований (ПМЗН) органов женской репродуктивной системы. Считается, что большинство из них являются гормонозависимыми опухолями, более того, отдельно был выделен синдром гормонозависимых аденокарцином в составе полинеоплазии.
И все же, по имеющимся наблюдениям, ПМЗН могут быть одним из проявлений различных наследственных синдромов, которые развиваются в большинстве случаев из–за наличия мутаций в генах–супрессорах опухоли [3]. И поэтому риск развития полинеоплазии выше для лиц из наследственно отягощенных семей.
Самой часто встречающейся разновидностью семейных опухолевых заболеваний у женщин является наследственный РМЖ (5–10% от общей встречаемости РМЖ) [2]. Классически разновидности наследственного РМЖ ассоциированы также с высоким риском развития РЯ, поэтому в литературе обычно используется термин «синдром РМЖ/РЯ» (breast–ovarian cancer syndrome). Доля наследственного РМЖ/РЯ в общей заболеваемости неоплазиями яичников еще более велика. Считается, что как минимум 10–15% случаев РЯ можно объяснить присутствием генетических факторов [10,16]. Установлено, что приблизительно в 20–30% случаев развитие наследственных форм РМЖ/РЯ обусловлено наличием мутаций в генах BRCA1 или BRCA2. Однако огромные усилия ученых направлены на идентификацию других генов, ответственных за развитие РМЖ и/или РЯ, которые позволили бы выявлять эти заболевания еще на доклиническом уровне.
Как и многие злокачественные опухоли, РМЖ и РЯ имеют мультифакторную природу. В их патогенезе важную роль играют онкогены и гены опухолевой супрессии. В основе инактивации генов–супрессоров опухолей и селективного роста злокачественно измененных клеток лежат генетические и эпигенетические повреждения. Механизмом эпигенетических изменений служит обратимое присоединение метильной группы к цитозину в CG–динуклеотидах (цитозин–гуанин–динуклеотидах), расположенных в регуляторных участках генов. Это явление получило название аномального метилирования генов в опухоли. Считается, что эпигенетические нарушения при малигнизации являются наиболее ранними и могут иметь место задолго до клинической манифестации заболевания [9]. К настоящему времени установлено, что метилирование генов ассоциировано с агрессивной формой опухоли и прогрессией заболевания [2,12,22]. Следовательно, определение степени метилирования генов–супрессоров опухолевого роста может служить ранним маркером агрессивности опухолевого процесса и применяться для прогноза течения заболевании и выработки стратегии при лечении РМЖ и РЯ.
Цель работы: комплексный анализ метилирования генов–супрессоров RASSF1A, SEMA3B и RARβ2 и изучение их роли в развитии РМЖ и РЯ.
Материалы и методы
В исследовании были использованы парные образцы опухолевой и прилежащей гистологически нормальной ткани, взятые у пациенток, которым до операции не проводилась лучевая или химиотерапия. Выборка составила 56 образцов РМЖ и 50 эпителиальных опухолей яичников. Все случаи классифицировали по TNM в соответствии с требованиями Международного противоракового союза (UICC, версия 1998 г.). Для отбора образцов с высоким содержанием опухолевых клеток проводился гистологический анализ микросрезов (толщина 5 мкм) после их окрашивания эозином и гематоксилином, что позволяло получить в исследуемом материале не менее 70% опухолевых клеток. Образцы тканей хранили при –70оС. В качестве дополнительного контроля использовали по 5 образцов ткани молочной железы и яичников, полученных от доноров без онкологических заболеваний в анамнезе. ДНК из ткани выделяли по стандартной методике [4]. Работа проведена на базе Государственного научного центра РФ «ГосНИИгенетика».
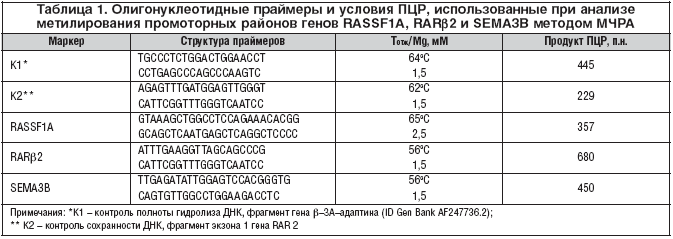
Анализ метилирования промоторных районов генов RASSF1A, RARb2 и SEMA3B методом метилчувствительного рестриктазного анализа (МЧРА) с использованием набора ферментов выполнен по аналогии c методом, основанным на способности метил–чувствительных рестриктаз гидролизовать ДНК, не содержащую модифицированных оснований, и оставлять не гидролизованными участки, содержащие 5–метилцитозин [4]. В соответствии с рестриктной картой промоторных CpG–островков исследованных генов применяли от двух до четырех метилчувствительных рестриктаз: HpaII (CCGG), HhaI (GCGC), AciI (CCGC) и Bsh1236I (CGCG). Расщепление ДНК рестриктазами HhaI и HpaII проводили в буфере Y, Bsh1236I – в буфере R, AciI – в буфере NEBuffer № 3. В качестве матрицы для ПЦР использовали парные образцы ДНК опухолевой и нормальной ткани до и после обработки ферментом. В качестве контроля сохранности ДНК (К2) применяли продукт ПЦР фрагмента экзона 1 гена RARβ2 (229 п.н.), т.к. этот фрагмент не содержит участков узнавания указанных рестриктаз. Полноту расщепления образцов ДНК ферментами проверяли с помощью амплификации фрагмента гена β–3A–адаптина (445 п.н.) (К1), который содержит неметилированные участки узнавания рестриктаз HpaII, HhaI, AciI и Bsh1236I (как в норме, так и при опухоли).
Праймеры и условия ПЦР приведены в таблице 1. ПЦР проводили в 25 мкл реакционной смеси, содержащей 67 мМ Трис–HCl, рН 9.3; 16,7 мМ (NH4)2SO4; 0,01% твин–20; 1,5–2,5 мМ MgCl2; 0,25 мМ каждого dNTP; 25 пМ каждого праймера; 1 ед. Hot Start Taq ДНК полимеразы (СибЭнзим); 5–20 нг ДНК пробы. Амплификацию осуществляли по следующей программе: 95оС – 2 мин.; 35 циклов (93оС – 20 c, Тотж – 30 с, 72оС – 20 с) и 72оС – 4 мин. ПЦР проводили на амплификаторе «Терцик» (Россия). Продукты ПЦР разделяли электрофорезом в 2% агарозном геле (табл. 1).
Статистический анализ проводился с использованием пакета прикладных программ Statistica for Windows 6.0. При анализе достоверности полученных данных был использован точный критерий Фишера. Достоверность считалась значимой, если p≤0,05 [28].
Результаты и обсуждение
Важно отметить, что клиническая информация для всех анализируемых групп больных не была известна до окончания изучения, которое показало, что из 59 изученных образцов РМЖ 12 принадлежали пациенткам с ПМЗО, а из 50 образцов РЯ 5 были с ПМЗО, одной из которых был РЯ.
Изучение метилирования ДНК в опухолях молочной железы и яичников проводилось с использованием МЧРА, что позволило не только более полно определить долю образцов, в которых эти гены метилированы, но и оценить плотность метилирования CpG–островка в каждом образце.
Анализ метилирования промоторного района гена RASSF1A при РМЖ и РЯ
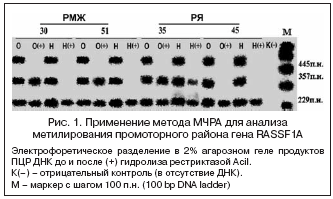
На рисунке 1 приведены типичные примеры анализа метилирования промоторного района гена RASSF1A с помощью МЧРА. Видно, что во всех 4 представленных случаях (и в О, и в Н) амплифицируется фрагмент 357 п.н. негидролизованного гена RASSF1A. В одном случае (РЯ 35) этот фрагмент амплифицируется и в опухолевой, и в прилежащей нормальной ткани после воздействия рестриктазы AciI. Это указывает на метилирование исследуемого участка как в опухоли, так и в прилежащей морфологически нормальной ткани. Напротив, в случае РЯ45 не наблюдали амплификации обработанного рестриктазой AciI фрагмента гена RASSF1A (357 п.н.) ни в опухолевой, ни в нормальной ткани, хотя четко прослеживается ПЦР–продукт исходной ДНК из опухоли и нормальной ткани (О/Н). На примере РМЖ 30 и 51, когда после гидролиза продукт ПЦР виден только в образцах опухолей, сохранение целостности ДНК во всех препаратах подтверждается образованием продукта ПЦР фрагмента RARβ2, может быть, RASSF1A (229 п.н., рис. 1, табл. 1), а полнота расщепления рестриктазой – амплификацией фрагмента гена β–3A–адаптина (445 п.н., рис. 1, табл. 1) только из негидролизованных ДНК (О/Н) и полным ее отсутствием после воздействия рестриктазой AciI.
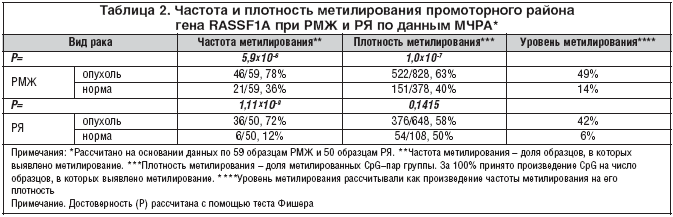
Согласно полученным данным, частота метилирования гена RASSF1A в опухолях молочной железы и яичников достоверно выше, чем в прилежащей гистологически нормальной ткани (р≤0,05) (табл. 2). Частота метилирования гена RASSF1A при РМЖ и РЯ составила 78% (46/59) и 72% (36/50) соответственно, что почти вдвое превышает данные, приведенные в литературе (40%) [13], хотя наблюдаемые различия в метилировании гена RASSF1A могут быть связаны как с чувствительностью метода, так и с этнографическими особенностями исследуемых популяций.
Плотность метилирования CpG–пар была менее выражена и, согласно данным МЧРА, достоверна только при РМЖ (p=1,6х10–5). Установлены четкие различия в уровнях метилирования промоторного района гена RASSF1A в опухолевой и прилежащей гистологически нормальной ткани при РМЖ (49% против 14%) и РЯ (42% против 6%) (табл. 2).
Следует отметить, что нами впервые была показана значимая корреляция частоты метилирования для гена RASSF1A при ПМЗО (р<0,05). Частота метилирования промоторной области гена RASSF1A составила 90% (12/11), причем у 6 пациенток наблюдался билатеральный РМЖ, а у 5 одной из первых опухолей был РМЖ. Метилирование гена RASSF1A также выявлено у 90% (4/5) больных с ПМЗО, у которых одной из первых опухолей был РЯ. Для всех пациенток с ПМЗО метилирование гена RASSF1A была найдено и в прилежащей гистологически нормальной ткани. В то же время метилирование промоторного района гена RASSF1A в ДНК, выделенной из 5 образцов тканей молочной железы и яичников, полученных от доноров без онкологических заболеваний в анамнезе, выявлено не было. Все это позволяет считать метилирование этого гена ранним событием в патогенезе РМЖ и РЯ и может быть использовано как молекулярный маркер злокачественной трансформации. Полученные нами данные согласуются с литературными данными, указывающими на то, что эпигенетические изменения в опухоли возникают раньше, чем структурные изменения ДНК и морфологические изменения в ткани [1,4,8,21].
В нашей работе, выполненной на представительной выборке (59 образцов РМЖ и 50 – РЯ), не найдено статистически достоверной зависимости частоты метилирования промоторной области гена RASSF1A от стадии, степени анаплазии и метастазирования опухолей (p=0,3–1,0, данные не приведены).
Анализ метилирования промоторного района гена RARb2 при РМЖ и РЯ
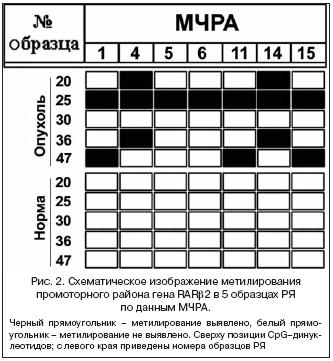
Методом МЧРА с использованием 3 метил–чувствительных рестриктаз HpaII, AciI и Bsh1236I суммарно тестировали 7 CpG–динуклеотидов, из них 3 CpG пары для HpaII (1, 11 и 15), 4 и 14 – для AciI и 5 и 6 – для Bsh1236I. В качестве примера на рисунке 2 представлены результаты анализа метилирования 5 парных образцов ДНК РЯ.
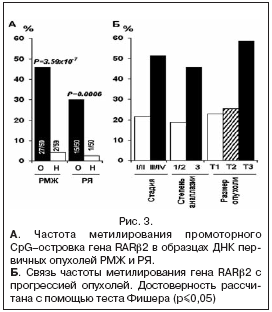
Проведенный нами анализ показал, что частота метилирования промоторного района гена RARβ2 составляет 46% (27/59) при РМЖ и 30% (15/50) при РЯ и статистически достоверно отличается от таковой в гистологически нормальной прилежащей ткани (р<0,05) (рис. 3).
У пациенток с ПМЗО метилирование этого гена выявлено в 67% (8/12) образцов с поражением молочной железы и у 90% (4/5) – с поражением яичника. Наличие метилирования промоторной области гена RARβ2 в некоторых образцах ДНК гистологически нормальной ткани молочной железы и яичников пациенток, выявляемое с частотой до 2–4%, означает, что эта модификация может происходить в начале онкогенеза, предшествуя структурным изменениям в ДНК тканей. В то же время метилирование промоторного района гена RARβ2 при дополнительном контроле выявлено не было.
Нами также была выявлена связь частоты изменения метилирования промоторного района гена RARβ2 со стадией, степенью анаплазии и размером опухоли при РМЖ (рис. 3Б). Другими авторами метилирование промоторной области данного гена было обнаружено в предраковых образованиях, а частота метилирования возрастала с прогрессией заболевания или с образованием карцином [15,19].
Выявленная зависимость изменения частоты метилирования от прогрессии опухоли позволяет включить ген RARβ2 в число эпигенетических онкомаркеров прогноза течения РМЖ.
Анализ метилирования промоторного района гена SEMA3B при РМЖ и РЯ
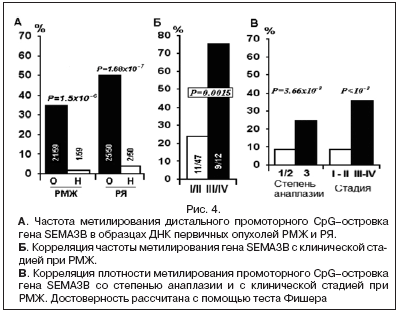
Методом МЧРА с использованием 2 метил–чувствительных рестриктаз HpaII и AciI было проанализировано 59 парных образцов РМЖ и 50 – РЯ. Проведенный анализ показал, что метилирование гена SEMA3B выявляется в 36% случаев РМЖ (21/59) и в 50% образцов РЯ (25/50) (рис. 4А). У пациенток с первично–множественным ракомчастота метилирования гена SEMA3B обнаружена в 33% (4/12) образцов с РМЖ и в 60% (3/5) образцов с РЯ. Кроме того, показано, что промоторная область гена SEMA3B достоверно чаще метилирована в ДНК опухоли, чем в ДНК прилежащей гистологически нормальной ткани молочной железы или яичников (p≤0,05 по Фишеру) (рис. 4A). В то же время метилирование промоторного района гена SEMA3B при дополнительном контроле выявлено не было. Эти данные указывают на функциональное значение и специфичность метилирования промоторной области вышеупомянутого гена в онкогенезе опухолей (рис. 4).
Выявлена достоверная корреляция частоты метилирования промоторного района гена SEMA3B с клинической стадией при РМЖ (p<0,05) (рис. 4Б). Нами рассчитана плотность метилирования CpG–островка гена SEMA3B (сумма метилированных CpG относительно суммы исследованных CpG в 21 образце ДНК первичных опухолей РМЖ и 25 образцах РЯ, в которых выявлено метилирование). Показана достоверная прямая корреляция плотности метилирования со степенью злокачественности и стадией при РМЖ (p<10–6 по Фишеру) (рис. 4В) и степени метилирования (с учетом плотности) с прогрессией РЯ (p≤0,05).
Данные о метилировании гена SEMA3B ранее были получены только для немелкоклеточного рака легкого, рака печени, нейробластомы и рака желчного пузыря [20,23,26].
Высокая частота метилирования в образцах ДНК опухолей и феномен выявления метилирования в нормальной ткани у пациентов с РМЖ и РЯ (еще до возникновения морфологических изменений) могут указывать на связь метилирования гена SEMA3B с началом онкогенеза, что важно для использования этого теста в качестве маркера при комплексной диагностике рака.
Заключение
Изучение статуса метилирования генов RASSF1A, RARb2 и SEMA3B показало, что их эпигенетическое изменение может быть одним из последовательных молекулярных изменений при РМЖ и РЯ, а метилирование генов RASSF1A и RARb2 коррелирует с тенденцией к развитию ПМЗО в молочной железе и яичниках. Возможно, метилирование ДНК является одной из самых значимых причин возникновения ПМЗО у пациенток. Выявленные особенности эпигенетических изменений генов RASSF1A, RARb2 и SEMA3B могут быть использованы не только с целью ранней диагностики РМЖ (RASSF1A), но и в качестве новых прогностических тестов (SEMA3B и RARb2), позволяющих выделять группы риска больных по развитию РМЖ и РЯ, как солитарных, так и первично–множественных.
Литература
1. Брага Э.А., Киселев Л.Л., Забаровский Е.Р. От идентификации геномных полиморфизмов к диагностическим и прогностическим маркерам эпителиальных опухолей человека // Молекулярная биология. 2004. Т. 38. С. 179–190.
2. Имянитов Е.Н., Хансон К.П. Молекулярная онкология: клинические аспекты. СПб., 2007. 211 с.
3. Казубская Т.П., Белев Н.Ф., Нефедов М.Д., Паяниди Ю.Г., Сельчук В.Ю. Клинико–генетический анализ первично множественных злокачественных новообразований // Российский онкологический журнал. 2007. № 2. С. 4–9.
4. Логинов В.И., Малюкова А.В., Серегин Ю.А., Ходырев Д.С., Казубская Т.П., Ермилова В.Д., Гарькавцева Р.Ф. с соавт. Уровень метилирования гена RASSF1A в эпителиальных опухолях почки, молочной железы и яичников // Молекулярная биология. 2004. T. 38. С. 654–667.
5. Попова Т.Н., Федоров В.Э., Харитонов Б.С. Первично–множественные синхронные злокачественные новообразования пищеварительной системы // Медицинский альманах. 2011. № 5. С. 76–79.
6. Статистика злокачественных новообразований в России и странах СНГ в 2010 г. / под ред. М.И. Давыдова, Е.М. Аксель. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2011. Т. 19. Приложение 1.
7. Чиссов В.И., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2010 г. (заболеваемость и смертность). М.: ФГБУ «МНИОИ им. П.А. Герцена» Минздравсоцразвития России. 2012. 260 с.
8. Angeloni D. Molecular analysis of deletions in human chromosome 3p21 and the role of resident cancer genes in disease // Brief. Funct. Genomic Proteomic. 2007. Vol. 6. № 1. P. 19–39.
9. Belinsky S.A., Nikula K.J., Palmisano W.A. et al. Aberrant methylation of p16 (INK4a) is an early event in lung cancer and potential biomarker for early diagnosis // Proc Natl Acad Sci USA. 1998. Vol. 95 (20). Р. 11891–11896.
10. Capen C.C. Mechanisms of hormone–mediated carcinogenesis of the ovary // Toxicol Pathol. 2004. Vol. 32. Suppl 2. Р. 1–5.
11. Clark S.J., Harrison J., Paul C.L., Frommer M. High sensitivity mapping of methylated cytosines // Nucl. Acids Res. 1994. Vol. 22. Р. 2990–2997.
12. Dammann R., Li C., Yoon J.H., Chin P.L., Bates S. and Pfeifer G.P. Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus 3p21.3 // Nat Genet. 2000. Vol. 25. Р. 315–319.
13. Dammann R., Schagdarsurengin U., Seidel C., Strunnikova M., Rastetter M., Baier K., Pfeifer G.P. The tumor suppressor RASSF1A in human carcinogenesis: an update // Histol Histopathol. 2005. Vol. 20 (2). Р. 645–666.
14. Dreijerink K., Braga E., Kuzmin I., Geil L. et al. The candidate tumor suppressor gene, RASSF1A, from human chromosome 3p21.3 is involved in kidney tumorigenesis // Proc Natl. Acad. Sci. 2001. Vol. 98. Р. 7504–7509.
15. Feng W., Shen L., Wen S. et al. Correlation between CpG methylation profiles and hormone receptor status in breast cancers // Breast Cancer Res. 2007. Vol. 9 (4). Р. 1–13.
16. Gadducci A., Cosio S., Gargini A., Genazzani A.R. Review Sex–steroid hormones, gonadotropin and ovarian carcinogenesis: a review of epidemiological and experimental data // Gynecol Endocrinol. 2004. Vol. (4). Р. 216–228. Review.
17. Galper S., Gelman R., Recht A. et al. Second non–breast malignancies after conservative surgery and radiation therapy for early–stage breast cancer // Int J Radiat Oncol Biol Phys. 2002. Vol. 52. Р. 406–414.
18. Ivanova T., Petrenko A., Gritsko T., Vinokourova S., Eshilev E., Kobzeva V., Kisseljov F., Kisseljova N.P. Methylation and silencing of the retinoic acid receptor–в2 gene in cervical cancer // BMC Cancer. 2002. Vol. 2. Р. 4–11.
19. Jing F., Yuping W., Yong C., Jie L., Jun L., Xuanbing T., Lihua H.В. CpG island methylator phenotype of multigene in serum of sporadic breast carcinoma // Tumour Biol. 2010. Vol. 4. Р. 321–331.
20. Kuroki T., Trapasso F., Yendamuri S., Matsuyama A., Alder H., Williams N.N., Kaiser L.R and Croce C.M. Allelic loss on chromosome 3p21.3 and promoter hypermethylation of Semaphorin 3B in non–small cell lung cancer // Cancer Res. 2003. Vol. 63. Р. 3352–3355.
21. Lerman M.I., Minna J.D. et al. The 630–kb lung cancer homozygous deletion region on human chromosome 3p21.3: identification and evaluation of the resident candidate tumor suppressor genes // Cancer Research. 2000. Vol.. 60. P. 6116–6133.
22. Marsit C.J., Houseman E.A., Christensen B.C. et al. Examination of a CpG island methylator phenotype and implications of methylation profiles in solid tumors // Cancer Res. 2006. Vol. 66 (21). Р. 10621–10629.
23. Nair P.N., McArdle L., Cornell J., Cohn S.L., Stallings R.L. High–resolution analysis of 3p deletion in neuroblastoma and differential methylation of the SEMA3B tumor suppressor gene // Cancer Genet. Cytogenet. 2007. Vol. 174. Р. 100–110.
24. Narod S.A., Foulkes W.D. BRCA1 and BRCA2: 1994 and beyond // Nat Rev Cancer. 2004. Vol. (9). Р. 665–676.
25. Pharoah P.D., Antoniou A., Bobrow M., Zimmern R.L., Easton D.F., Ponder B.A. Polygenic 48 susceptibility to breast cancer and implications for prevention // Nat Genet 2002. Vol. 31. Р. 33–36.
26. Tischoff I., Markwarth A., Witzigmann H., Uhlmann D., Hauss J., Mirmohammadsadegh A., Wittekind C., Hengge U.R., Tannapfel A. Allele loss and epigenetic inactivation of 3p21.3 in malignant liver tumors // Int. J. Cancer. 2005. Vol. 115. Р. 684–689.
27. Tomizawa Y., Kohno T., Kondo H., Otsuka A. et al. Clinicopathological signifycance of epigenetic inactivation of RASSF1A at 3p21.3 in stage I lung adenocarcinoma // Clin. Cancer Res. 2002. Vol. 8. Р. 2362–2368.
28. Weir B.S. Genetic data analysis. Sunderland, MA: Sinauer. 1990.

