Нестероидные противовоспалительные препараты. Опыт применения кетопрофена в гинекологической практике
Нестероидные противовоспалительные препараты. Опыт применения кетопрофена в гинекологической практике
Авторы этой брошюры – врачи Государственного учреждения Эндокринологического научного центра Российской Академии медицинских наук, Елена Николаевна Андреева, гинеколог-эндокринолог, доктор медицинских наук, заведующая отделом репродукции ЭНЦ РАМН, Дмитрий Анатольевич Деркач и Елена Анатольевна Карпова, кандидат медицинских наук – научные сотрудники отдела репродукции Центра.
Нестероидные противовоспалительные препараты (НПВП) – лекарственные средства, наиболее широко применяемые в медицине, благодаря их противовоспалительным, анальгезирующим и жаропонижающим эффектами (4,12). Исторически это наиболее старая группа противовоспалительных средств. В 1827 году из коры ивы, жаропонижающее действие которой было известно с давних пор, был выделен гликозид салицин. Через 9 лет из него была получена салициловая кислота, осуществлен полный синтез этой кислоты и ее натриевой соли, в 1869 - синтезирована ацетилсалициловая кислота. В настоящее время имеется большой (более 25 наименований) арсенал НПВС, а в практической медицине используется для лечения более 1000 созданных на их основе лекарственных средств.
Особенность современных НПВС - многообразие лекарственных форм, в том числе для местного применения в виде мазей, гелей, а также свечей и препаратов для парентерального введения (7). Большинство препаратов группы НПВС относится, по современной терминологии, к "кислотным" противовоспалительным средствам, являясь производными органических кислот и обладая рН=4,0.
Общие черты НПВС с клинической точки зрения:
1. Неспецифичность противовоспалительного эффекта, т.е. тормозящее влияние на любой воспалительный процесс независимо от его этиологических и нозологических особенностей.
2. Сочетание противовоспалительного, болеутоляющего и жаропонижающего действий.
3. Хорошая переносимость.
4. Тормозящее влияние на агрегацию тромбоцитов.
5. Связывание с альбуминами сыворотки, причем между различными препаратами существует конкуренция за места связывания. Это имеет существенное значение, поскольку с одной стороны, несвязанные лекарства быстро выводятся из организма и не оказывают своего основного действия, а с другой стороны, освобожденные из связи с альбумином лекарственные средства, могут создать необычно высокую концентрацию и вызвать побочные эффекты.
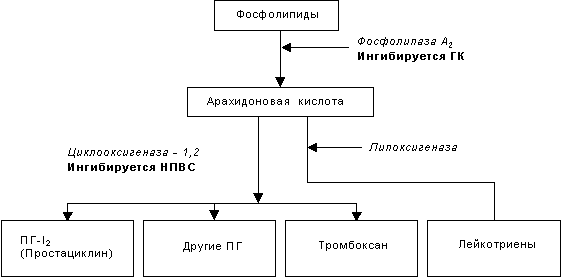
Рис. 1 МЕХАНИЗМ ДЕЙСТВИЯ НПВС.
Несомненно, наиболее важным механизмом действия НПВС -способность ингибировать циклооксигеназу (ЦОГ) - фермент, катализирующий превращение свободных полиненасыщенных жирных кислот (например, арахидоновой) в простагландины (ПГ), а также другие эйкозаноиды - тромбоксаны (ТрА2) и простациклин (ПГ-I2) (рис. 1).
Доказано, что простагландины имеют разностороннюю биологическую активность:
а) являются медиаторами воспалительной реакции, накапливаясь в очаге воспаления, вызывают локальное расширение сосудов, отёк, экссудацию, миграцию лейкоцитов и другие эффекты (в основном ПГ-Е2 и ПГ-I2);
б) сенсибилизируют рецепторы к медиаторам боли (гистамину, брадикинину) и механическим воздействиям, понижая порог чувствительности;
в) повышают чувствительность гипоталамических центров терморегуляции к действию эндогенных пирогенов (интерлейкина-1 и др.), образующихся в организме под влиянием микробов, вирусов, токсинов (главным образом ПГ-Е2).
В последние годы установлено, что существует, как минимум, два изофермента циклооксигеназы, которые ингибируются НПВС (15, 16). Первый изофермент - ЦОГ-1 - контролирует выработку ПГ, регулирующих целостность слизистой оболочки желудочно-кишечного тракта, функцию тромбоцитов и почечный кровоток, а второй изофермент - ЦОГ-2 - учавствует в синтезе ПГ при воспалении. Причём ЦОГ-2 в нормальных условиях отсутствует и образуется под действием некоторых тканевых факторов (цитокины и другие), инициирующих воспалительную реакцию. В связи с этим предполагается, что противовоспалительное действие НПВС обусловлено ингибированием ЦОГ-2. Выраженность противовоспалительных свойств НПВС коррелирует со степенью ингибирования ЦОГ (1, 3, 10). Не менее важна способность НПВС блокировать взаимодействие брадикинина с тканевыми рецепторами, что приводит к восстановлению нарушенной микроциркуляции, уменьшению перерастяжения капилляров, снижению выхода жидкой части плазмы, ее белков, провоспалительных факторов и форменных элементов, опосредованно влияя на развитие других фаз воспалительного процесса.
Определенное значение в механизме противовоспалительного действия НПВС имеют ингибирование освобождения гистамина и серотонина, а также блокада тканевых реакций на эти биогенные амины, которые играют существенную роль в воспалительном процессе.
В последние годы значительное развитие получили исследования влияния НПВС на клеточные механизмы воспалительной реакции. Доказано, что НПВС уменьшают миграцию клеток в очаг воспаления.
Боль с точки зрения физиологии - сильнейший повреждающий фактор, приводящий к развитию в организме специфических нейро-физиологических реакций и усиливающий течение патологического процесса. Начальным звеном любого острого или хронического болевого синдрома являются периферические болевые рецепторы и афференты. Их раздражение происходит при повреждении тканей, сопровождающимся выделением периферических медиаторов боли – простагландинов и кининов. При сильном остром (хирургическом, травматическом) повреждении тканей чрезмерный простагландино- и кининогенез приводит к перевозбуждению переферических болевых рецепторов (переферическая синситизация), а затем и афферентных ноцицептивных путей, способствуя формированию центральной сенситизации. Последняя сопряжена с включением целого ряда патологических нейрогуморальных механизмов, обуславливающих формирование трудно устранимых острых и хронических болевых синдромов. В связи с этим, важным в патогенетическом отношении фактором снижения интенсивности болевых синдромов является своевременное фармакологическое торможение процессов переферической медиации боли с помощью анальгетиков периферического действия (7).
Анальгезирующий эффект НПВС в большей степени проявляется при болях слабой и средней интенсивности, которые локализуются в мышцах, суставах, сухожилиях, нервных стволах.
Некоторые ПГ (Е2 и F2a) могут повышать чувствительность болевых рецепторов к физическим и химическим стимуляторам, например, к действию брадикинина, который в свою очередь способствует высвобождению ПГ из тканей. Таким образом, происходит взаимное усиление альгогенного действия. НПВС, блокируя синтез ПГ-Е2 и ПГ-F2a, в сочетании с прямым антибрадикининовым действием, препятствуют проявлению альгогенного эффекта (13).
НПВС непосредственно на болевые рецепторы не действуют, однако, блокируя экссудацию, стабилизируя мембраны лизосом, они опосредованно снижают число чувствительных к химическим раздражителям рецепторов.
Кроме того, определенное значение придается влиянию этой группы препаратов на таламические центры болевой чувствительности (локальная блокировка ПГ-Е2, F2aв ЦНС), которое приводит к торможению проведения болевых импульсов к коре (11).
Болевые синдромы следует разделить на две основные группы: острые и хронические, которые отличаются по причинам и механизмам развития.
Принципы медикаментозного лечения болевых синдромов:
1. Применяется единая тактика лечения острых и хронических болевых синдромов, основанная на строгом соответствии назначаемых средств обезболивания интенсивности боли. Последняя устанавливается врачом по простой шкале (рис.2).
|
Боли нет |
Слабая |
Умеренная |
Сильная |
Очень сильная |
|
0 баллов |
1 балл |
2 балла |
3 балла |
4 балла |
Рис. 2. Шкала вербальных оценок.
Подразделение интенсивности боли на 4 ступени имеет большое значение для практического здравоохранения, так как показанем к назначению сильнодействующих наркотических средств является только сильный и очень сильный (3 – 4 балла) болевой синдром.
Слабый болевой синдром (1 балл) устраняют с помощью анальгетиков периферического действия (кетопрофен, диклофенак и др.).
При умеренной боли (2 балла) назначают опиоидный анальгетик центрального действия (трамал, трамадол), не относящийся к наркотическим средствам, в сочетании с ненаркотическими анальгетиками периферического или центрального действия.
Истинные наркотические средства назначают только при сильных (3 – 4 балла) болевых синдромах.
Такая тактика обезболивания позволяет предотвратить неоправданное назначение сильнодействующих наркотиков не нуждающимся в них пациентам и избежать возможных осложнений, связанных с угнетающим действием наркотиков на жизненно важные функции.
2. Лечение боли должно быть, по возможности, этиопатогенетическим, т.е. направленным на устранение причин, вызывающих боль, а не симптоматическим. Это наиболее радикальный подход, дающий быстрый положительный результат.
3. Назначаемая врачом пациенту средство обезболивания должно быть адекватно интенсивности боли и безопасно для пациента, т.е. должно устранять боль не вызывая серьезных побочных эффектов.
В случае назначении анальгетика, недостаточного для устранения боли, последняя сохраняется и начинает быстро нарастать за счет суммации болевых стимулов и перевозбуждения проводящих боль нервных структур; в результате формируется трудно устранимый болевой синдром.
Не следует назначать сильное наркотическое средство при слабой и умеренной боли. Известны случаи глубокой медикаментозной депрессии ЦНС, остановки дыхания и кровообращения у пациентов в ранние сроки после малых оперативных вмешательств в результате назначения им для обезболивания мощных опиоидов (8).
Болевой синдром, требующий назначения анальгетиков – это, прежде всего, послеоперационный и посттравматический, связанный с хирургическим или травматическим повреждением тканей. Как указывалось выше, пусковым механизмом этих видов синдромов является возбуждение множества болевых периферических рецепторов выделяющимися при травме медиаторами – альгогенами. Кроме того, в очаге боли и травмы всегда присутствуют элементы воспаления и отека.
По мнению многих исследователей, ближайший посленаркозный период рассматривают как слабое звено анестезиологического пособия (рис.3)
Рис. 3 Патогенез развития болевого синдрома.
По данным американских ученых после 33 – 75% операций, ежедневно производившихся в США в 90-е годы прошлого столетия, в раннем послеоперационном периоде пациенты предъявляли жалобы на среднюю и сильную боль, несмотря на проводимое обезболивание. В начале 90-х годов ушедшего столетия сообщалось о неадекватном обезболивании в послеоперационном периоде в клиниках Германии, Великобритании и других стран.
Сложный патогенез послеоперационного болевого синдромасвязан с реакцией всех систем организма в ответ на хирургическую травму тканей. Хирургические манипуляции (рассечение, сдавление, ишемизация, растяжение, частичное или полное удаление органов и тканей) приводят к формированию первичного периферического очага острой боли, в котором с момента нанесения травмы начинаются активные нейрогуморальные процессы, являющиеся источником восходящего болевого (ноцицептивного) потока (рис. 4).
Рис. 4 Патогенез послеоперационного болевого синдрома
Интенсивность ноцицептивной импульсации зависит от объема травмированных тканей, длительности, объема и площади повреждения, а так же от близости расположения зоны хирургических манипуляций к рефлексогенным зонам. В конечном субъективном ощущении боли особое место надо отвести ее эмоциональной окраске, которая во многом зависит от идивидуальных особенностей личности пациента (2).
Традиционные методы послеоперационного обезболивания на основе наркотических анальгетиков независимо от способа их введения в организм больного (системно, эпидурально, интраректально), даже при применении больших доз, не устраняют стрессовой реакции на операционную травму и связанные с ней нарушения гомеостаза (прессорные сердечно-сосудистые реакции, переферический вазоспазм, снижение тканевого и органного кровотока, метаболический ацидоз, нарушение реологических свойств крови, склонность к тромбообразованию, гиповолемии и др.). Как показывает клиническая практика, с помощью обычных терапевтических доз наркотических анальгетиков невозможно добиться полноценной аналгезии после больших внутриполостных операций, а увеличение доз препаратов обычно сопровождается тяжелыми побочными эффектами, дополнительно осложняющими состояние оперированного больного (сонливость, адинамия, угнетение дыхания, гиповентиляция легких, нарушение перестальтики пищеварительного тракта и др.). Особо опасным представляется использование наркотических анальгетиков в ближайшем посленаркозном периоде из-за усиления центральной депрессии вплоть до нарушения витальных функций. Преимущества НПВС перед наркотическими анальгетиками: не угнетают дыхательный центр, не вызывают эйфорию и лекарственную зависимость.
Недостаточная эффективность послеоперационной моноаналгезии опиатами очевидна в свете данных последних фундаментальных исследований, механизмов боли и обезболивания (14). Известно, что наркотические анальгетики, реализующие свое действие через опиатные µ-рецепторы на спинальном и супраспинальном уровня, не влияют на первичный (периферический) пусковой механизм послеоперационной боли, связанный с раздражением болевых рецепторов альгогенами, выделяющимися при повреждении тканей. Как указывалась выше, простагландины, кинины, лейкотриены и другие биологически активные вещества также ответственны за развитие процессов воспаления и отека в ране, усугубляющих боль и функциональные расстройства в оперированных органах и тканях.
По мнению многих специалистов, наиболее перспективное направление связано с профилактическим принципом в лечении боли. При этом важнейшая роль в снижении выраженности послеоперационного болевого синдрома принадлежит ненаркотическим агентам – анальгетикам периферического действия, подавляющим зарождающееся болевое возбуждение (равно как и воспаление) у самых истоков, т.е. на уровне болевых (ноцицептивных) рецепторов операционной раны. В этом плане в последние годы внимание клиницистов приковано к нестероидным противовоспалительным средствам.
Можно отметить более высокую анальгезирующую активность дериватов пропионовой кислоты: кетопрофена, ибупрофена, флубипрофена.
К числу наиболее эффективных НПВП несомненно относится кетопрофен – 2-3 бензол фенил-пропионовая кислота. Препарат синтезирован в 1967 г., в 1971 году был признан «молекулой года», а с 1973 года широко используется в клинической практике во всех странах мира (17), в том числе и в России. Одной из наиболее популярных форм кетопрофена, зарегистрированных в России, несомненно, является Кетонал (компания LEK, Словения). Противовоспалительные эффекты кетопрофена были продемонстрированы в классических тестах, характеризующих противовоспалительную активность НПВП. В многочисленных исследованиях показано, что кетопрофен ингибирует синтез ПГЕ2 при пероральном, интраректальном и внутривенном введении лабораторным животным, подавляя развитие отека, индуцированного каррагенином и адьювантного артрита у крыс, а также эритемы, вызванной ультрафиолетовым облучением у морских свинок. По противовоспалительной активности кетопрофен сходен с индометацином, несколько превышает напроксен и существенно – ацетилсалициловую кислоту. По жаропонижающей активности кетопрофен примерно в 3-4 раза активней индометацина. Исследования, касающиеся селективности кетопрофена в отношении изоформ циклооксигеназы показывают, что он сходен в этом отношении с другими НПВС (флюрбипрофен, ибупрофен, индометацин, пироксикам, напроксен) (таб.1) (5).
Таблица 1.
Сравнительная антипростагландиновая
и анальгетическая активность НПВС
|
Препарат |
Ингибиция ЦОГ |
Анальгетическая активность |
||||
|
|
Сильная |
Умеренная |
Слабая |
Сильная |
Умеренная |
Слабая |
|
Кетопрофен |
|
+ |
|
++ |
|
|
|
Флюрбипрофен |
+ |
|
|
+ |
|
|
|
Дифлунисал |
|
|
+ |
+ |
|
|
|
Напроксен |
|
|
+ |
+ |
|
|
|
Диклофенак |
+ |
|
|
|
+ |
|
|
Этодолак |
+ |
|
|
|
+ |
|
|
Сулиндак |
+ |
|
|
|
+ |
|
|
Набуметон |
|
|
+ |
|
|
+ |
С фармакологической точки зрения кетопрофен характеризуется следующими особенностями: он очень быстро абсорбируется в ЖКТ и достигает максимальной концентрации в плазме в течение 1-2 час., препарат обладает коротким периодом полувыведения и быстро выводится из организма. Это снижает риск его аккумуляции даже у больных пожилого возраста с нарушением функции печени и почек (18).
Наиболее хорошо изучено его центральное противоболевое действие, которое обусловлено:
- способностью быстро проникать через гемато-энцефалический барьер (ГЭБ), благодаря исключительной жирорастворимости;
- способностью оказывать центральное воздействие на уровне задних столбов спинного мозга путём ингибирования деполяризации нейронов задних столбов;
- способностью контролировать уровень некоторых нейротрансмиттеров, таких как серотонин (через влияния на G-протеин и предшественник серотонина 5-гидрокситриптамин), уменьшать выработку субстанции Р (6).
Результаты клинических исследований свидетельствуют о хорошей переносимости кетопрофена как при кратковременном, так и при длительном приеме. Приемлемая безопасность кетопрофена подтверждается данными Комитета по контролю за безопасностью препаратов в Великобритании и в США (таб. 3, 4).
Таблица 2.
Частота осложнений на фоне лечения НПВС
|
Препарат |
Тяжелое поражение ЖКТ |
Общее число тяжелых побочных реакций |
Частота смертельных случаев |
|
Кетопрофен |
33,2 |
38,6 |
1,6 |
|
Пироксикам |
58,7 |
68,7 |
6,2 |
|
Дифлунисал |
33,5 |
47,2 |
3,5 |
|
Напрксен |
32,8 |
41,1 |
5,6 |
|
Флюрбипрофен |
24,7 |
35,8 |
3,3 |
|
Сулиндак |
23,9 |
53,4 |
5,1 |
|
Диклофенак |
20,9 |
39,4 |
3,1 |
|
Ибупрофен |
6,6 |
13,2 |
0,7 |
Таблица 3.
Частота гастроэнтерологических побочных эффектов.
|
Препарат |
Число больных в год |
Абсолютное число осложнений |
Частота % |
|
Кетопрофен |
506 |
7 |
0,96 (0,31-1,78) |
|
Ибупрофен |
1999 |
19 |
0,94 (0,55-1,38) |
|
Диклофенак |
1042 |
12 |
0,93(0,43-0,51) |
|
Аспирин |
6201 |
74 |
1,13 (0,88-1,43) |
|
Напрксен |
3364 |
38 |
1,20 (0,77-1,64) |
|
Флурбипрофен |
251 |
4 |
1,24 (0,16-3,18) |
|
Пироксикам |
1592 |
24 |
1,39 (0,85-2,01) |
|
Индометацин |
968 |
28 |
2,96 (1,97-4,31) |
Из представленных таблиц видно, что среди других НПВП, кетопрофен занимает третье место по общей безопасности и второе – по частоте смертельных побочных эффектов. Высокая эффективность и безопасность кетопрофена послужила основанием для разрешения выпуска безрецептурной таблетированной формы (9).
В качестве эффективного и относительно безопасного анальгетика кетопрофен широко используется в акушерстве и гинекологии. Его применение позволяет избежать назначения наркотических анальгетиков для купирования болевого синдрома как после проведения оперативных вмешательств и оперативного родоразрешения, так и при воспалительных заболеваниях органов малого таза.
Значительный интерес представляет дисменорея, как проявление нарушения синтеза простагландинов. Последним можно объяснить такие проявления этого синдрома, как сильные спазмы во время менструации, вздутие живота, болезненность молочных желез, изменение настроение, головная боль, отеки и, нередко, менорагия. Методом выбора является назначение нестероидных противовоспалительных средств. Особенно ценно противовоспалительное действие кетопрофена, позволяющее уменьшить отек и экссудацию тканей внутренних половых органов при их остром или хроническом воспалении.
Кроме того, есть публикации, что использование нестероидных противовоспалительнх препаратов может привести к уменьшению кровопотери при хроническом метроэндометрите и аденомиозе.
Целью нашей работы стала оценка кетонала как средства профилактики и лечения послеоперационного болевого синдрома с определением его эффективности и переносимости с различной гинекологической патологией.
В исследование были включены 63 пациентки, обратившиеся к гинекологу-эндокринологу отделения ГУ ЭНЦ РАМН по поводу различных гинекологических заболеваний. Все больные были разделены на 2 группы.
Первую группу составили 33 пациентки в возрасте 33,8 ± 10,6 лет с различной патологией наружных и внутренних половых органов: врожденная дисфункция коры надпочечников – 1 больная; чистая агенезия гонад – 1 больная; синдром поликистозных яичников – 4; миома матки – 4; хроническое воспаление придатков матки с нарушением функции яичников– 9; аденомиоз – 4; кисты яичников различной этиологии – 6; 4 - с различной внутриматочной патологией. 27 больным из них были проведены адекватные объемы оперативных вмешательств эндоскопическим доступом или лапаротомия.
В раннем послеоперационном периоде 32 больным этой группы препарат назначался в дозировке 200 мг в сутки в течение 5 дней. Одной больной, 12 лет, по 100 мг один раз в день.
Интенсивность болевого синдрома в обеих группах оценивали через 30', 60' и 6 часов после первого введения препарата по простой шкале вербальных оценок: 0 – боли нет; 1 – слабая боль; 2 – умеренная боль; 3 – сильная боль; 4 – очень сильная боль. Регистрировали разовые и суточные дозы кетонала. Продолжительность анальгезии, дополнительные анальгетики. О переносимости терапии судили по характеру, частоте и выраженности побочных эффектов в баллах (0 – нет, 1 – слабо, 2 – умеренно, 3 – сильно выражено).
Во вторую группу вошли 30 пациенток с различной патологией шейки матки, из них: псевдоэрозия – 29, лейкоплакия – 1. Возраст больных составил 29,4 ± 6,3. Больным этой группы проводили различные виды минимальноинвазивных вмешательств: биопсия шейки матки, криодеструкция, диатермокоагуляция, с последующим назначением кетонала в разовой дозировке 100 мг в/м.
У двух больных I группы потребовалось дополнительное однократное назначение промедола из-за большого объема и травматичности операции.
Введение первой послеоперационной дозы кетонала пациентам II группы производили на фоне появления болевого синдрома слабой или умеренной степени (1,5 ± 0,6 балла). Только двум пациенткам в связи с большим объемом оперативного вмешательства, жалобами на сильную боль, дополнительно были назначены опиоиды.
В обеих группах независимо от способа введения кетонала (внутримышечно или ректально), ослабление боли наступало к 30 мин., максимальный эффект достигался через один час. Продолжительность анальгезии при в/м введении 100 мг кетонала составила 7,8 ± 2,1 часа, при ректальном введении – 10,4 ± 2,3 часа. Следует подчеркнуть, что 54,6% пациентов первая послеоперационная доза кетонала привела к полному устранению боли и в дальнейшем для поддержания отличной или хорошей анальгезии (0 – 1 балл по ШВО) в течении всего послеоперационного периода было достаточно моноанальгезии кетоналом (200 мг в сутки) без дополнительного применения опиоидов.
Побочные эффекты были выявлены у 3 больных первой группы. У одной из них – обострение хронического гастрита на 4-е сутки приема препарата, у двух других – диарея, что послужило поводом для отмены препарата. Во второй группе побочных явлений не было.
Таким образом, профилактическое внутримышечное или ректальное введение кетонала в раннем послеоперационном периоде, предотвращает развитие сильного болевого синдрома и создает условие для поддержания полноценной моноанальгезии кетоналом как после полостных, так и после малоинвазивных гинекологических операций. Применение кетонала способствует профилактике послеоперационного болевого синдрома, улучшает течение послеоперационного периода, позволяя проводить малые гинекологические операции в амбулаторно-поликлинических условиях, не требует госпитализации пациенток в стационар.
Список литературы.
1. Астахова А.В. «Побочные реакции, вызываемые нестероидными противовосполительными средствами». - Безопастность лекарств. - Бюл. - N 2. - 1998 – С. - 3 - 8.
2. Ветшев П.С. «Принципы аналгезии в раннем послеоперационном периоде». – Хирургия - N. - 2 - 2002 - C. - 49 - 52.
3. Гринько А.В., Муравьев Ю В. «Нестероидные противовоспалительные препараты и желудочно-кишечный тракт». – РМЖ - 1998 - Т. - 6 – N – 13 – C. - 829 - 831.
4. Насонов Е.Л. «Нестероидные противовоспалительные препараты (Перспективы применения в медицине)». – Москва - «АНКО» - 2000 - С. - 143.
5. Насонов Е.Л. «Кетопрофен: новые аспекты применения в клинической практике». - Российская ревматология - N - 3 - 1999 - С. - 9 - 16.
6. Новиков Г.А. «Кетонал в лечении болевого синдрома у пациентов с распространенными формами злокачественных новообразований». - Палиативная медицина и реабилитация - N – 3 – 4 - 2002 – C. - 49.
7. Осипова Н.А. «Анальгитики переферического действия (кетонал) в лечении острого и хронического болевого синдрома». - Вестник интенсивной терапии – N – 5 – 6 - 1999 - раздел - 1.
8. Осипова Н.А. «Порядок и сроки назначения наркотических анальгетиков». – Москва - 2001 - С. - 10 - 11.
9. Adams S.S. «Nonsteroidal anti-inflamatori drugs, plasma half-life and advers reactions». – Lancet - 1987 - 2 – Р. 1204 - 1205.
10. Balfor J.A. Lornoxicam. «A review of its pharmacology and therapeutic patential in the management of painful and inflammatory conditions». - Drugs - 1996 - N – 51 – P. - 639 - 57.
11. Bannwarth B at al. «Central analgesic effects of aspirin-like drugs». - Fund. Clin. Pharm. – 1995 – N - 9 – P. - 1 - 7.
12. Brooks P.M. «DAYRO non-steroid antiinflamatory drugs: differences and similarities». - N. Engl. J. Med. – 1993 – N – 324 – P. - 1716 - 1725.
13. Mc. Cormack K. «Nonsteroidal anti-inflamatori drugs and the dissociation between their anti-inflamatori and analgesic effects». - Drugs. – 1994 – N – 47 – Suppl - 5 – P. 28 - 45.
14. Shnitzer T.J. «Non-NSAID pharmacologic treatment options for the management of chronic pain». - Am. J. Med. – 1998 – N - 105 – P. - 45 - 52.
15. Vane J.R. «Ingibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs». - New. Biоl. - 1971 – N – 231 –P. - 232 – 235.
16. Vane J.R. «Mechanism of action anti-inflamatori drugs: an overiew». - Kluwer Academic Publisher – 1997 – Р. – 1 - 17.
17. Waldem W. «Analgesic effects and tolerance of ketoprofen and diclofenak in acute uretral colic». - Scand. J. Urol. Nephrol. – 1993 - N – 27 – P - 323 - 325.
18. Williams R.L. «The clinical pharmacology of ketoprofen». - J. Clin. Pharmacol. - 1988 – N – 28 - P. - 13 - 22.

