Такой подход позволит персонализировано определять стратегию ведения пациентов, снизить частоту хирургического лечения и определить объем оперативного вмешательства, оптимизировать назначение дополнительных терапевтических мероприятий.
В 2014 году в рамках проекта TCGA было проведено исследование 496 случаев папиллярного рака щитовидной железы с использованием методов полногеномного, полноэкзомного и полнотранскриптомного секвенирования, что позволило выявить новые драйверные мутации, в том числе точечные мутации в новых, ранее не описанных генах. Также было обнаружено, что изменения числа копий генов при отсутствии других мутаций, могут рассматриваться в качестве самостоятельных драйверных событий, то есть инициирующих превращение нормальной клетки в раковую.
За период с 2014 года по настоящее время было выявлено более 40 генов, мутации в которых могут являться драйверными при раке щитовидной железы, и иметь диагностическую значимость. Значительную долю новых выявляемых мутаций составляют новые генные перестройки тирозинкиназ, при этом они часто ассоциируются с неблагоприятным прогнозом.
Высокопроизводительное таргетное секвенирование позволяет единовременно анализировать неограниченный спектр мутаций, что необходимо для анализа соматических мутаций, при этом оставаясь в доступном ценовом диапазоне для использования в клинической практике.

Такой подход позволит персонализировано определять стратегию ведения пациентов, снизить частоту и планировать масштаб оперативных вмешательств, оптимизировать назначение дополнительных терапевтических мероприятий (радиойодтерапия, тирозинкиназные ингибиторы).
Проведение испытаний (секвенирование) рабочих параметров созданной тест-панели
Испытание рабочих параметров выполнено на узкой панели праймеров (на точеные мутации в 25 генах, изменения копийности в регионах 1q, 9q, 17q, 22q).
Тестирование выполнено на клеточных линиях SW620, MCF, HT29, K562; клиническом материале рака ЩЖ.
Секвенирование выполнено на платформах Ion PGM™ и Ion S5™, точечные мутации определены с помощью инструмента Torrent Variant Caller Plugin, генные перестройки – с помощью специализированного инструмента Ion Reporter™ Software, CNVs – OncoCNV.
Оценка параметров чувствительности и специфичности разработанных тестов
С помощью портала BioPortal выполнен предварительный анализ in silico чувствительности разработанной панели на 399 образцах папиллярного рака и 117 образцах низкодифференцированного и анапластического рака.
Чувствительность разработанной расширенной панели составила:
· 99% на образцах папиллярного рака
· 96% на образцах низкодифференцированного и анапластического рака
Специфичность (вероятность реальных отрицательных результатов) узкой панели праймеров, оцененной на данном этапе, составила 100%: в образцах нормальной ткани не выявлены таргетные мутации (при условии минимальной частоты мутантного аллеля – 5%).

Клинический опыт
Выполнено исследование методом таргетного высокопроизводительного секвенирования расширенного спектра генетических изменений в свежезамороженном материале доброкачественных и злокачественных новообразований щитовидной железы.
Таргетное высокопроизводительное секвенирование 92 образцов выполнено на платформах IlluminaNextSeq 550 (для библиотек на точечные мутации, инсерции/делеции) и IlluminaMiSeq (для библиотек на генные перестройки) с использованием специализированных наборов IlluminaNextSeq 550 SystemMid-OutputKit и MiSeqReagentKitv2 Micro соответственно.
Количество прочтений, полученных на платформе IlluminaNextSeq 550 – 149 189 638 ридов.
· Количество прочтений, полученных на платформе IlluminaMiSeq – 2 174 619 ридов.
Результаты валидации на репрезентативной выборке
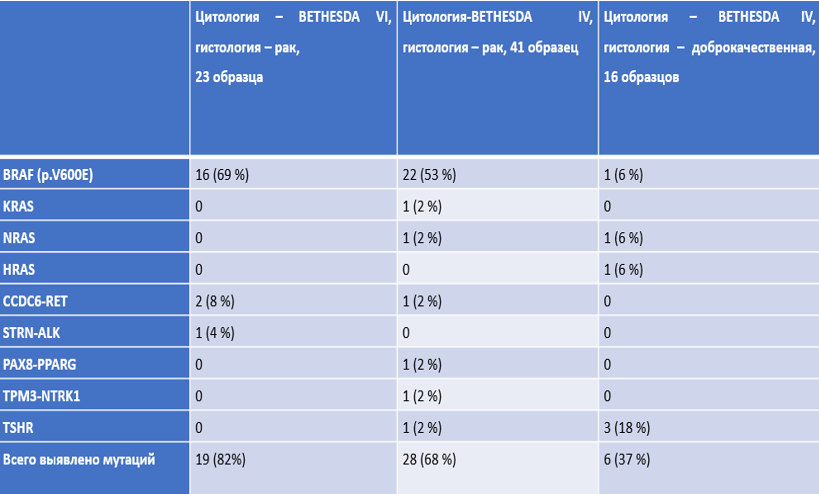
Суммарно распространенность мутаций по всем образцам представлена на рисунке
Исследованные генетические изменения включили точечные мутации, короткие инсерции/делеции, изменения копийности, перестройки в генах с известной диагностической значимостью и генах без оценки ассоциации со злокачественностью и клинико-морфологическими характеристиками.
Выявленные частоты:
· Мутаций BRAF - 59,4%, соответствует верхней границе частот
· Мутаций RAS - в одинаковом количестве при доброкачественных и злокачественных новообразованиях (по 2 образца), небольшой объем выборки не позволяет дать достоверную оценку частоты
· Мутаций CCDC6-RET - 12,5%
· Мутаций ALK, NTRK1, NTRK3 в сумме в трех случаях рака
· Мутаций TERT – в 10,9% случаев рака щитовидной железы
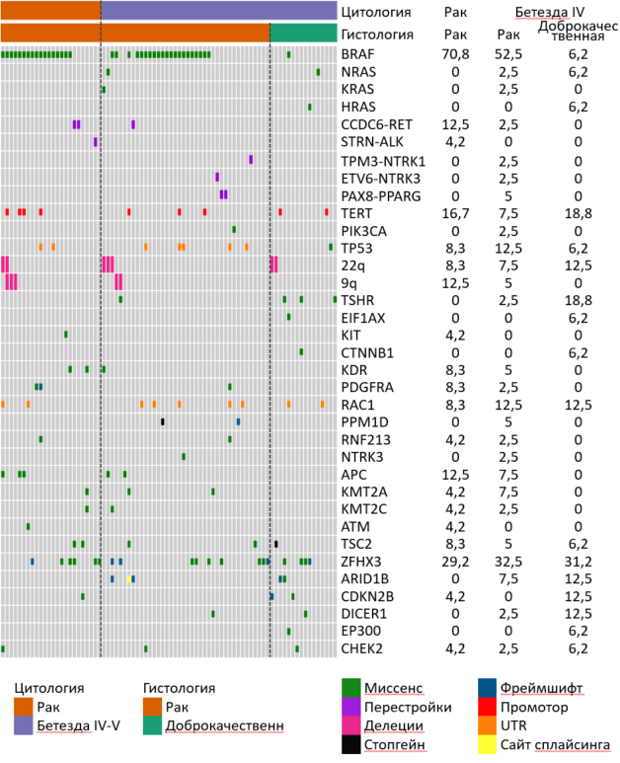
Определение мутаций в промоторном регионе гена TERT имеет важное значение в диагностике и прогнозировании течения заболевания. Во всех случаях мутации TERT были сопредставлены с мутациями BRAF. Обнаруженные в отсутствии других драйверных мутаций мутации TERT не являются достаточным критерием для определения образцов как злокачественные.
Также выявлена мутация EIF1AX в одном случае доброкачественного новообразования, что подтверждает ассоциацию мутаций EIF1AX с доброкачественными новообразованиями.
Одинаковая распространенность вариантов в опухолевых супрессорах ZFHX3, ARID1B, CDKN2B, DICER1, CHEK2 при раке и доброкачественных новообразованиях щитовидной железы может говорить о низкой диагностической точности таких вариантов.
Отсутствие в нашем исследовании выявленных мутаций онкогенов PIK3CA, AKT1, AKT2, AKT3, SOS1, IDH1, MET, JAK2, IDH2, ALK, EZH1 может свидетельствовать об их низкой распространенности при раке щитовидной железы.
В результате исследования дана характеристика распространенности драйверных мутаций с известной диагностической значимостью и мутаций в генах, описанных в литературе без установленной диагностической значимости, при доброкачественных и злокачественных новообразованиях щитовидной железы.
Панель позволит врачам и пациентам:
1. Проводить дифференциальную диагностику, чтобы установить единственно правильный диагноз
2. Вести адекватное динамическое наблюдение
3. Оценить необходимость операции в каждом отдельном случае и оптимизировать ее объем
4. Правильно выстроить послеоперационное наблюдение
5. Выстроить оптимальную послеоперационную тактику ведения пациентов.
Аналоги в России и мире
В отечественной медицине данному методу не существует аналогов. Подобные технологии сегодня успешно применяются только в Америке.
Основной конкурентной технологией является тест-система для диагностики рака щитовидной железы на основании анализа мутаций (точечных, генных перестроек, изменения копийности) ThyroSeq v3.
Разработанная нами панель праймеров позволяет анализировать мутации, не включенные в ThyroSeq v3, в том числе в генах AKT3, PPM1D, TSC1, SPOP, AKT2, CDKN2A, CDKN2C, KMT2A, KMT2C, NF1, ARID1B, RB1, SOS1, ATM, ATR, ZFHX3, BRD4. Спектр анализируемых аберрантно экспрессированных генов превышает ThyroSeq v3 за счет генов JUN, LMNA, NKX2-1.
Многие врачи и пациенты понимают необходимость внедрения в клиническую практику инновационных молекулярно-генетических методов исследования. Разработанная панель позволит обеспечить высокую эффективность дифференциальной диагностики заболеваний щитовидной железы, так как характеризуется более высокой чувствительностью и прогностическим значением.
Диагностическая тест-система «THYRONOSTICS» совместима с платформами секвенирования как Ion S5 Series, Ion GeneStudio S5, PGM, Proton так и Illumina MiSeq, NextSeq, HiSeq Series.
Платформы для секвенирования идеально подходят для высокопроизводительного секвенирования в крупных федеральных больницах, а настольный MiSeqDx может использоваться в лабораторных помещениях стандартных клинических центров.

